CRISPR/Cas9作为一项有力的基因编辑工具,已经被广泛应用于生物医学研究领域。随着研究的深入,越来越多与其相关的研究工具已经被开发出来,包括基因敲除,基因过表达,将外源片段定点整合进入基因组,单碱基编辑,文库高通量筛选等。
目前已有不少在体的研究也都在利用CRISPR/Cas9技术。在结合AAV病毒载体后,拥有广泛的应用前景和临床意义1。但很多在体研究还局限在敲除基因上面,原因是CRISPR/Cas9介导的KO依赖的是DNA双链断裂修复后引入或者缺失片段导致的移码,相对较容易实现。如果想要精确的编辑某个基因,例如进行单碱基突变或者插入某个片段或者精确删除某个DN**段则难度较高。
因为常规的看法是,这类精确编辑依赖的是HDR(同源重组介导的修复),但HDR的编辑效率非常低,体外研究通常占比低于5%。且HDR修复通路具有强烈的细胞周期依赖,发生在S/G2期,所以利用HDR来进行在体的基因编辑其效果受到很大限制,应用较少。
特在此为大家推荐其它一些高效且精确的基因编辑策略或者技术,这些方案都可以通过AAV或者慢病毒载体来实现。
# 单碱基编辑技术
在单碱基编辑技术出现之前,为了在基因上引入单碱基突变,只能依赖HDR修复途径。而这个过程需要产生DNA双链断裂,还要引入donor序列,且效率非常低。
将胞嘧啶脱氨酶rAPOBEC1融合到dCas9的N端使得该融合蛋白可以将胞嘧啶(C)的氨基水解掉,从而变成尿嘧啶(U),这个水解过程发生在与sgRNA非互补的链上。由于尿嘧啶不是DNA的常规组分,细胞内的碱基切除修复通路(BER),将会识别DNA中的尿嘧啶,并将其切除,而这将抑制单碱基编辑的效率。一段尿嘧啶糖基化酶抑制剂(UGI)序列被融合到dCas9蛋白的C端,可以有效地阻止编辑点附近尿嘧啶被切除。
此时该位点的序列为U:G配对,随着着细胞分裂将产生两个子细胞,在该位点的序列分别为U:A和C:G。其中U:A的子细胞序列进一步分裂或者通过BER修复就变成T:A配对,最终完成C:G到T:A的转变2。
由于最后一步的编辑依赖细胞分裂,为了降低这种依赖性,并进一步提高编辑效率,如何将非分裂细胞中的U:G突变成U:A就成了下一个研究的关键点。细胞内存在另外一条错配修复通路(MMR),可以将错配的碱基进行修复,例如前面不匹配的U:G。
如何让MMR将U:G配对修复为U:A而非C:G呢?MMR会将含有缺刻的一条链识别为新合成的DNA链,从而切除这条链上错配的碱基,并以另外一条链为模板进行修复。因此通过将dCas9的HNH酶切位点恢复活性,就可以切割与sgRNA互补的DNA链,即U:G配对中碱基G所在的链(图1)。
相对于利用HDR引入点突变,单碱基编辑的效率明显提高,达到15%-75%。这意味着如果在体实验需要引入或者修正点突变,完全可以通过单碱基编辑技术实现。前面介绍的这个技术可以实现CT或者GA的突变,而如果将这个系统中胞嘧啶脱氨酶替换成腺嘌呤(A)脱氨酶,则可以实现AG或者TC的突变3。并且更适合AAV载体的saCas9也开发出了相关的系统4。
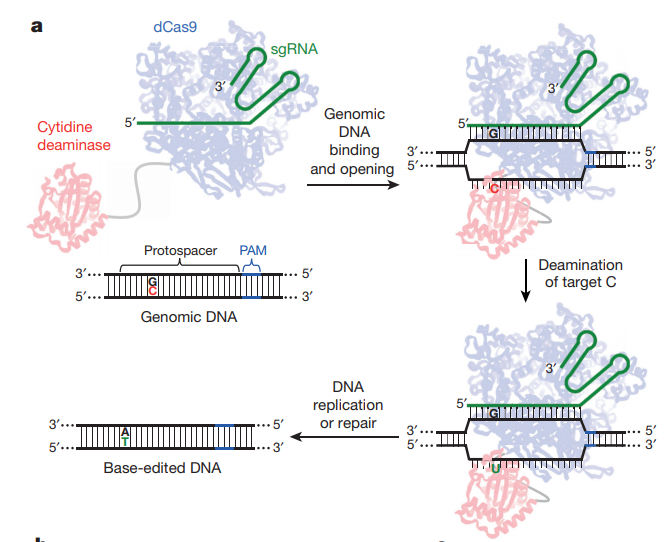
图 1 单碱基编辑示意图
#非同源依赖的片段整合(HITI)
如果想在体地在基因中引入某些片段,HDR的低效同样使人望而却步。在此也为大家介绍一项更高效的片段整合的技术HITI。众所周知,末端连接修复通路(NHEJ或者MMEJ)可以将两个断裂末端连接起来。
因此,在我们预想插入DN**段的位置通过CRISPR/Cas9系统切割生成一个断裂末端,此刻断裂点附近如果有DN**段,这个DN**段很可能会被通过末端连接的方式整合进入基因组,这也就是HITI的基本原理。这里提到的DN**段也是一段donor序列,和HDR过程中提供的donor相比,HITI的donor序列只需要包含插入序列,而不需要两侧的同源序列。与HDR对比,HITI由于依赖的是末端连接的修复方式,其效率要高出非常多。且由于不依赖于细胞周期,可以用于终末分化的体细胞的编辑5。
这里简单介绍一下HITI的donor序列的设计。对于HDR,由于有两侧的同源序列,所以不用担心插入片段的方向问题。但对于HITI,由于依赖的是末端连接的修复方式,所以如何避免片段被反向连入是需要考虑的问题。作为解决方案,在HITI的donor质粒中引入一个和基因组上靶点相同的序列,但方向和相对于插入序列的方向和基因组上靶点方向相反。
所以该序列也会被sgRNA识别并切割,切割之后如果正向连接进入预期位置,连接位置不会形成新的sgRNA靶点。但如果是反向连接进预期位置,就会和载体上序列重新形成sgRNA靶点,从而被二次识别并切割,从而保证了插入序列的方向性(图2)。
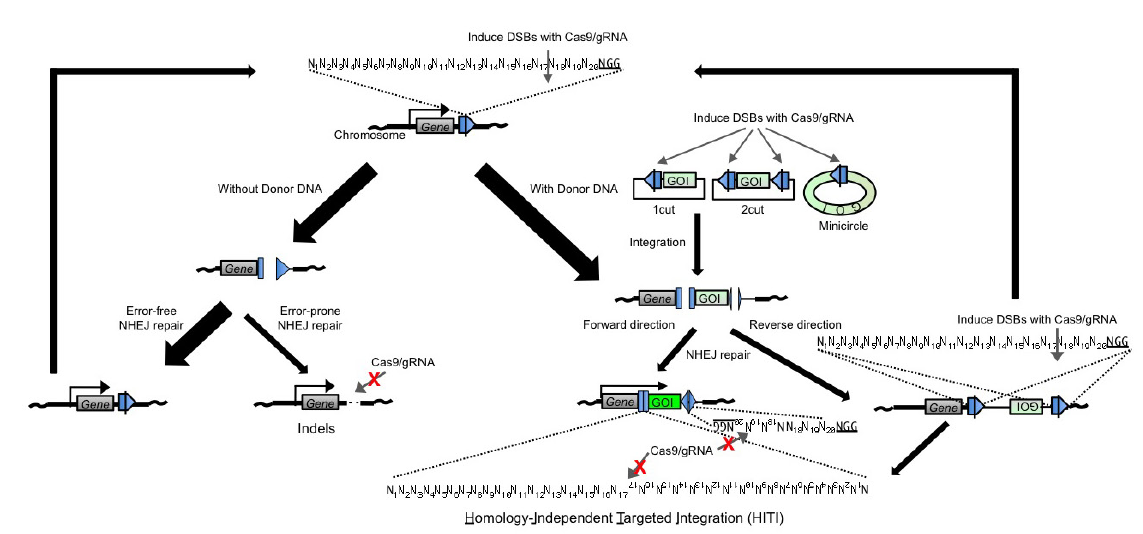
图 2 通过控制donor质粒上靶点的方向实现插入片段的定向插入
可以看到HITI的修复效率相较于HDR高出非常多(图3),并且虽然长期认为末端连接的修复方式将引入小片段的插入或者确实(indel),但从实验结果看,没有indel的修复结果依然占据了多数。这很可能与NHEJ的修复方式有关系,已有报道证明NHEJ连接两个没有修饰的断裂末端时,会倾向于无indel的修复结果。典型的,如将CtiP敲除,将促进NHEJ,而导致片段敲除中精确连接的比例明显升高。
因此无论是从修复效率来看,或者是精确修复的绝对比例看,HITI都是更适合体内研究片段插入的技术。
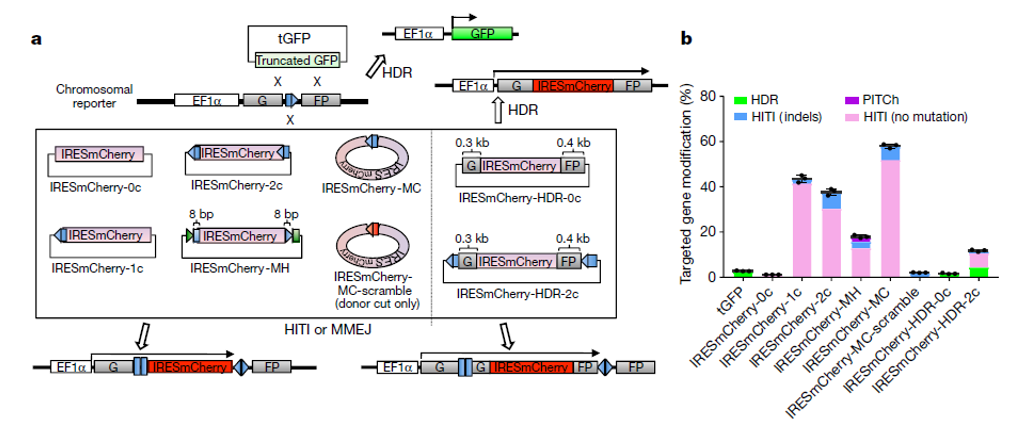
图 3 HITI修复效率于HDR对比
#微同源介导片段删除
对于精确的片段插入或者点突变我们都介绍了相对于HDR更高效的方案,那么对于片段的精确删除是否也有更高效的方案呢?在特定情况下是有的。
我们之前有介绍过,CRISPR/Cas9所介导的DNA双链断裂的修复结果并不是随机的(注意!Cas9介导DNA双链断裂修复结果不是随机的!)
具有高度可重复性。虽然目前还不确定这种修复结果的有序性具体是如何实现的,但是可以明确是,和细胞本身的DNA双链断裂修复系统,细胞周期,DNA断裂点附近序列有高度的相关性。
因此通过大数据分析结合机器学习,在一定程度上可以预测修复后的DNA序列。图4和图5介绍了两个预测修复结果的网站6 7。图中用于预测的序列具有很强的微同源重复序列,预测结果都显示近80%比例的基因组在修复后将缺失中间8bp重复序列。
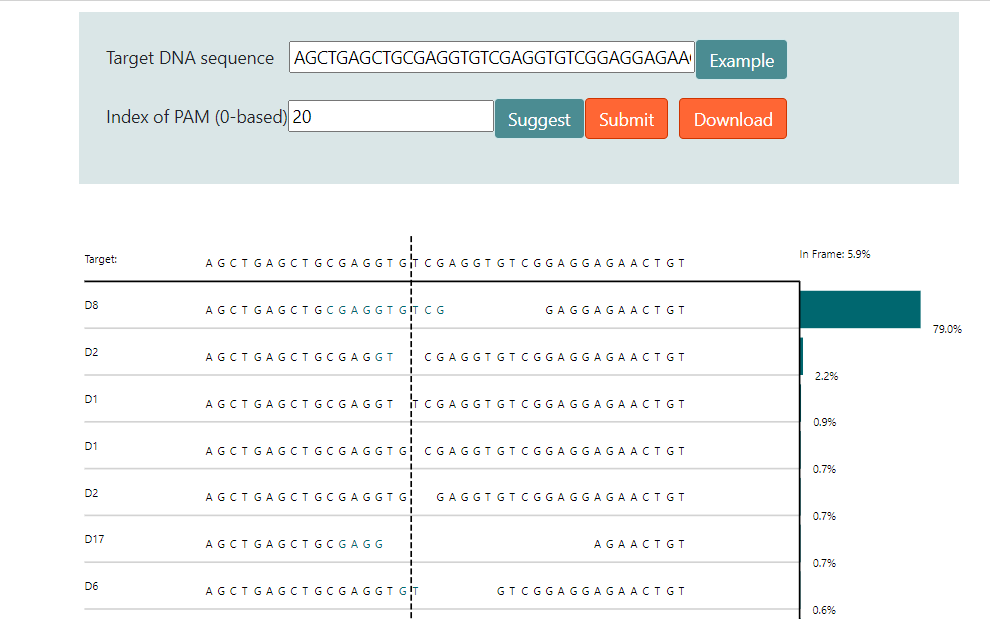
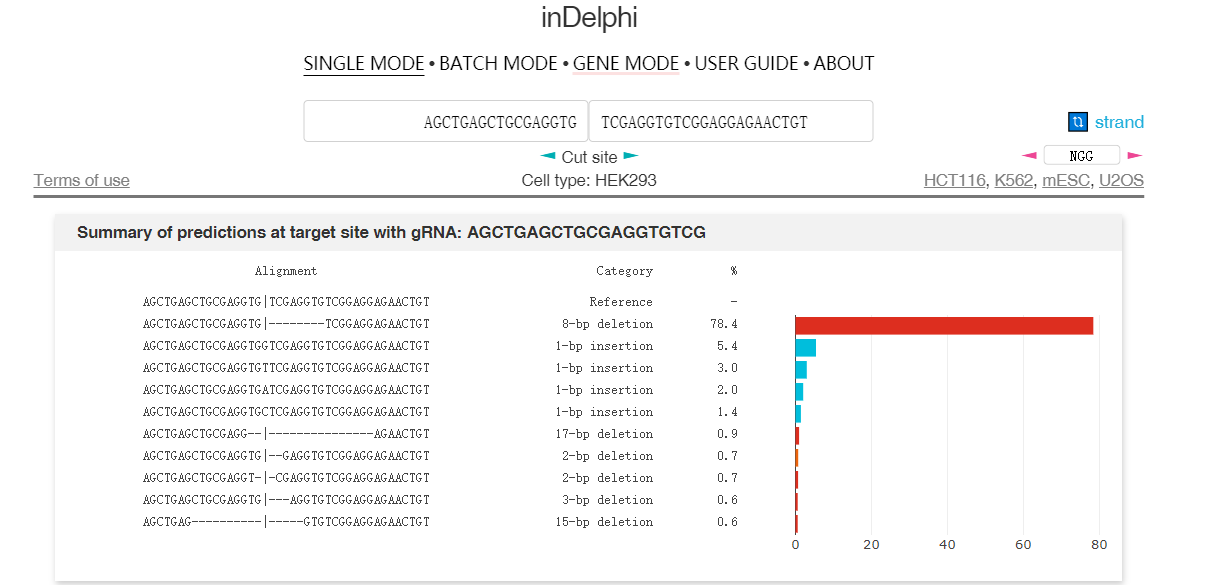
实际上这段序列来源于另外一篇研究MMEJ精确介导重复片段删除的文章,上面两个预测结果和文章内实验结果高度吻合8。TCAP基因中8bp的重复将导致阅读框移码从而失活蛋白,最终导致后肢肌肉不良综合征(LGMD2G)。当在重复序列附近设计sgRNA靶点,通过Cas9切割产生双链断裂后,细胞将利用MMEJ修复通路删除重复的序列。
从结果看,在编辑后77%的细胞至少拥有了一个野生型基因(图6)。这暗示我们,对于拥有某些特定序列的基因组,在双链断裂后,其修复结果会更倾向于形成单一的修复结果,尤其是部分具有高度微同源序列的DNA。
利用这种特性,我们可以实现特定片段的精确删除,且具有超高的效率。但是需要注意的一点是,MMEJ和HDR一样具有细胞周期的依赖性,主要发生在S/G2期,因此如果用该方案去编辑已经退出分裂周期细胞或者终末分化的细胞,将极大地影响效率。
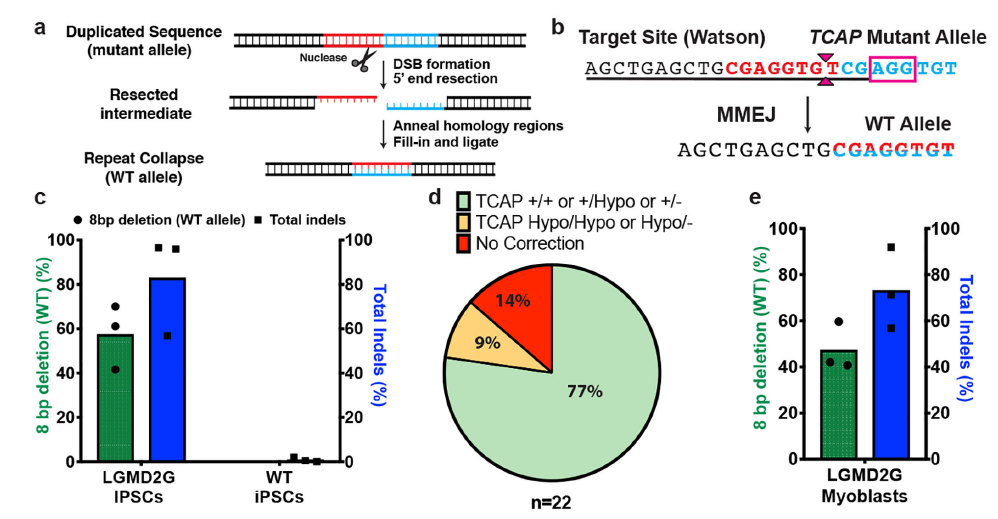
图 6 MMEJ修复切除重复片段
对于本期介绍到的技术,如果感兴趣,欢迎致电吉凯进行咨询探讨。

