
期刊:Proceedings of the National Academy of Sciences
影响因子:9.4
伯豪技术服务:单细胞核转录组测序、伯优®细胞核分离试剂盒
研究背景
背景:m7G甲基转移酶复合体组分WDR4的突变在神经性疾病患者中常见,但机制不明。
科学问题:WDR4调控神经疾病的分子机制;该机制在治疗中的潜在应用价值。
实验材料:C57BL/6N小鼠、人类iPSC诱导分化成的神经元细胞。
表型:源自病人的WDR4突变导致小鼠特定类型神经元随时间退化,进而导致小鼠神经系统发育紊乱。
机制:
1. WDR4点突变抑制WDR4和METTL1之间的互作,使得METTL1蛋白加速降解;
2. Wdr4突变使tRNA m7G修饰下调,进而下调mTOR通路相关mRNA的翻译,引发内质网应激,上调神经元细胞凋亡;
应用:
1. TUDCA处理可以显著缓解Wdr4突变带来的神经元死亡,提升Wdr4突变小鼠的神经元功能;
2. AAV病毒转导回补野生型WDR4,能够恢复小鼠大脑METTL1蛋白及tRNA m7G修饰水平,对Wdr4突变小鼠具有长效治疗效果;
3. 对具有临床病人WDR4突变的人类iPSC诱导成的神经元细胞进行TUDCA处理和WDR4回补,细胞存活率和功能性均有显著提升。
伯豪产品
单细胞核转录组测序、转录组测序、TRAC-seq、多核糖体测序
(单细胞和转录组测序服务由伯豪生物提供)
研究结果
1. WDR4突变导致发育、运动和智力缺陷
临床上,患者常见的WDR4突变是170位的精氨酸(R)突变成亮氨酸(L),作者通过Wdr4基因的定点突变,使小鼠WDR4 215R突变为L,由此构建出WDR4临床突变的小鼠模型(Wdr4R21L/R215L,下称“突变小鼠”;Fig. 1A-C)。相比于野生型小鼠(Wdr4+/+),突变小鼠出现严重的发育迟缓,体重、体型和存活时间显著降低(Fig. 1D-G)。另一方面,作者也对野生型和突变小鼠的运动平衡能力和认知能力进行了检测和比较,发现8周龄的突变小鼠在上述方面均存在显著的缺陷,而4周龄小鼠则没有显著差异(Fig. 1H-P)。
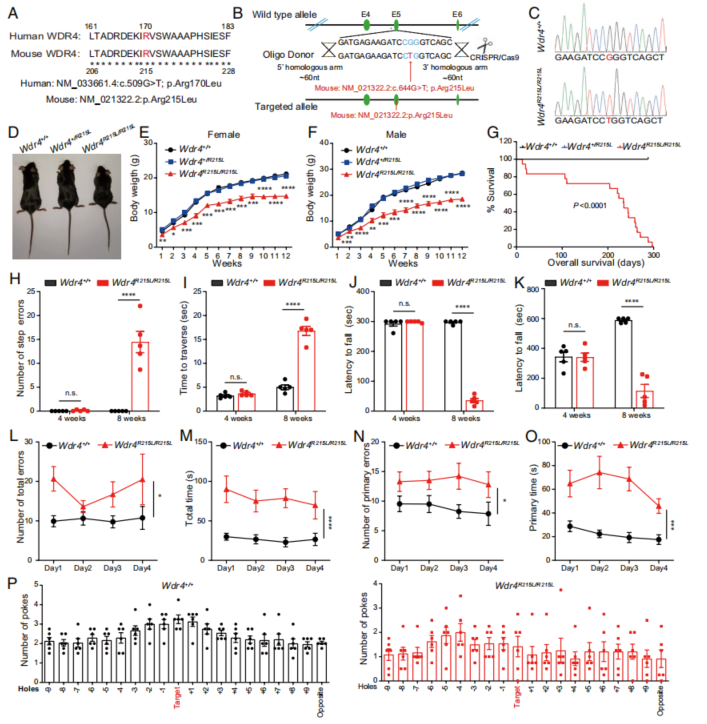
Fig. 1. Wdr4突变引起发育、动作和智力缺陷
2. WDR4点突变导致神经元细胞死亡和小头畸形
如同临床上的WDR4突变病人会出现小头畸形,8周龄的突变小鼠相较于野生对照组,脑部尺寸和重量上也显著降低,大脑皮层无显著差异,但小脑萎缩严重,伴有小脑中凋亡细胞数目的显著上调(Fig. 2A-H, L-N)。考虑到突变小鼠在4周龄没有形态、认知和行为上的显著缺陷,所以作者也对2周至8周之间的多个年龄时间点的小鼠小脑进行了定量分析,可见突变型小鼠的小脑萎缩表型在5周(Day 35)后开始显现,主要体现在小脑皮层中IGL(internal granule layer,内部颗粒层)和ML(molecular layer,分子层)的面积显著降低(Fig. 2I-K)。
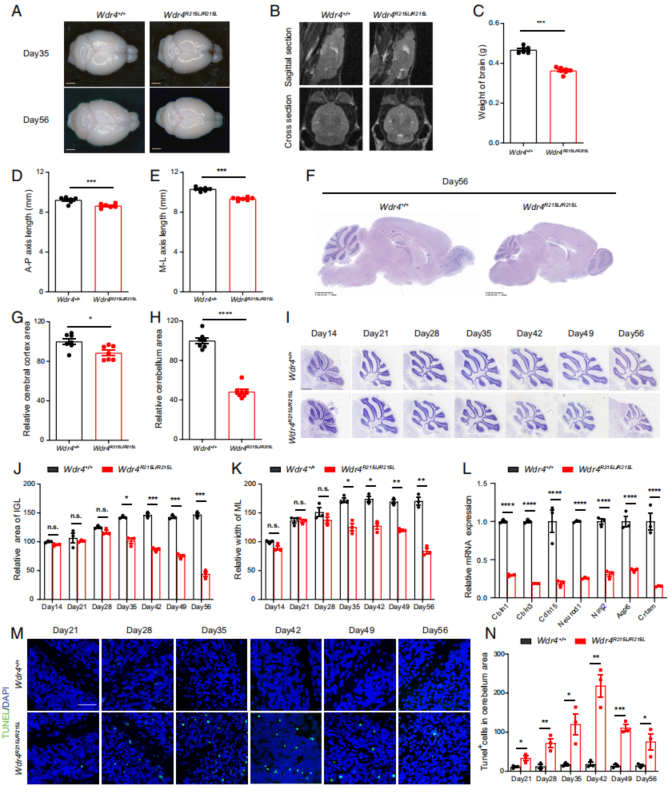
Fig. 2. WDR4点突变引起神经细胞死亡和小头畸形
3. Wdr4突变小鼠脑部特定类型细胞随时间退化
上述小脑萎缩的病理过程也暗示了METTL1/WDR4通过tRNA m7G调控脑部发育与稳态的机制也可能具有时序上的特征。因此,作者在野生型小鼠中检测了1日龄至8周龄之间多个时间点的METTL1和WDR4蛋白水平,发现二者在4周(Day 28)前随时间逐渐升高,在Day 28左右达到峰值,随后开始逐渐下降(Fig. 3A)。
为了在单细胞水平上探究Wdr4突变带来的影响,作者选取8周龄(Day 56)小鼠进行单细胞核测序(snRNA-seq;测序服务由伯豪生物提供),通过已知的脑部细胞marker对聚类后的数据进行了注释,并对在数量上占绝大多数的神经元细胞进行了进一步的亚型细分与注释(Fig. S2A, F, G; Fig. 3B)。在神经元细分成的14个亚群中,Subcluster 0在突变小鼠中几乎消失,该细胞亚型中,颗粒层细胞marker Gabra6和Etv1特异性高表,暗示了Wdr4点突变对小脑颗粒层细胞退化的特异性调控(Fig. 3B-D)。GO富集分析的结果显示Subcluster0显著下调的差异基因(DEGs)主要富集于神经元形态异常和小脑形态异常等通路(Fig. 3E, F)。
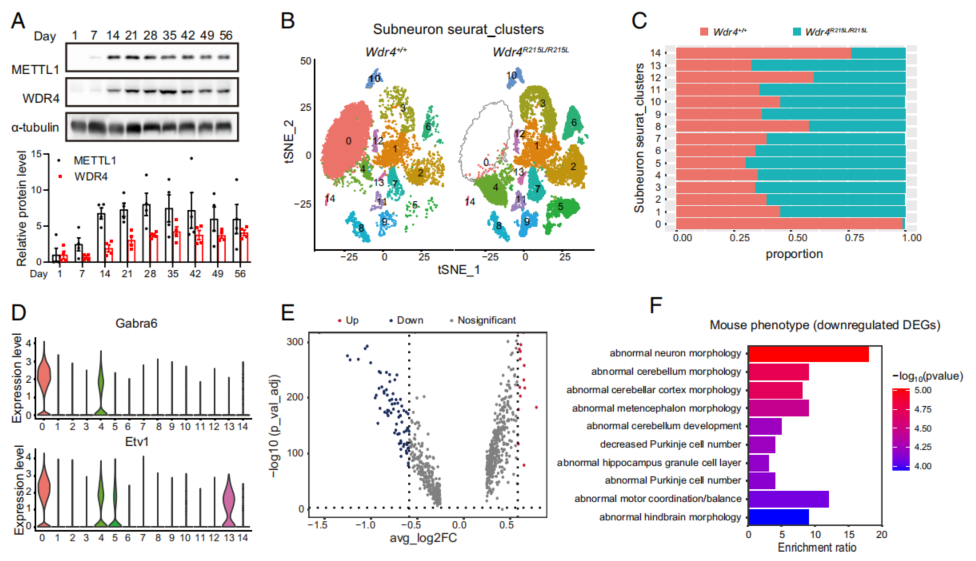
Fig. 3. Wdr4点突变小鼠脑部出现特定细胞类型随时间退化
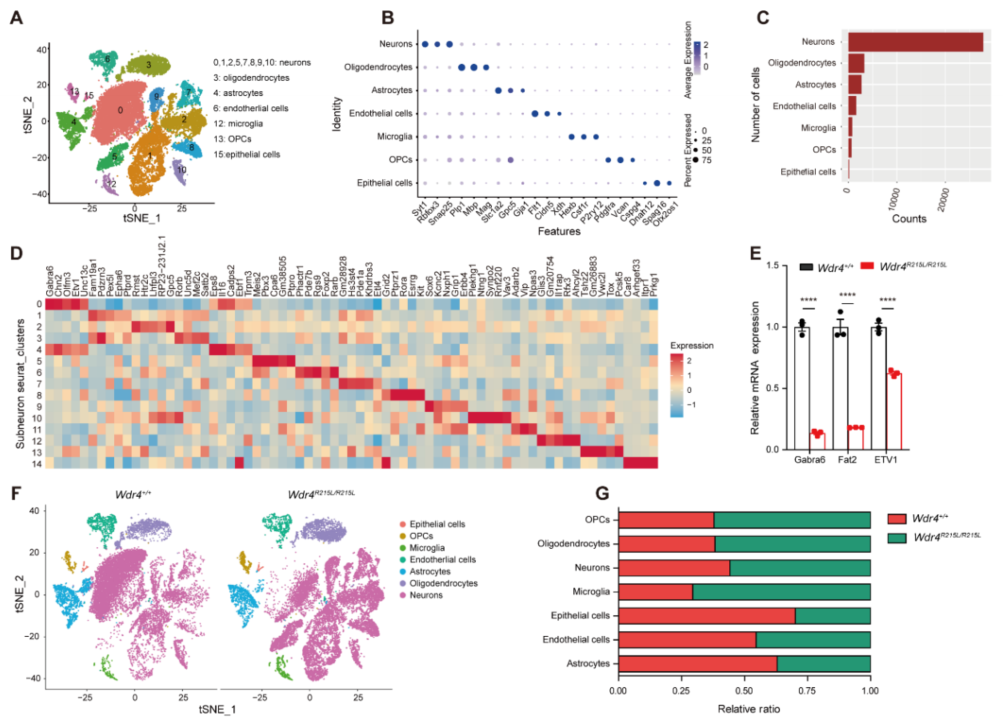
Fig. S2. 2月龄小鼠脑部snRNA-seq分析
4. Wdr4点突变抑制其自身与METTL1的互作并降低METTL1稳定性
以往的研究报道了METTL1/WDR4催化tRNA的m7G修饰这一机制,于是作者以此为基础,进一步探究METTL1和WDR4在突变小鼠中的表达情况。脑部的METTL1在小脑中高表而在其他区域的表达量较低(与小脑萎缩表型相符),Wdr4的点突变显著下调了tRNA的m7G水平和METTL1的蛋白水平,但是对后者的转录水平没有显著性的影响,而蛋白酶体抑制剂MG132的处理使得Wdr4突变的原代神经细胞中METTL1的蛋白水平显著上调,暗示了Wdr4点突变导致了METTL1蛋白的降解(Fig. 4A-E)。
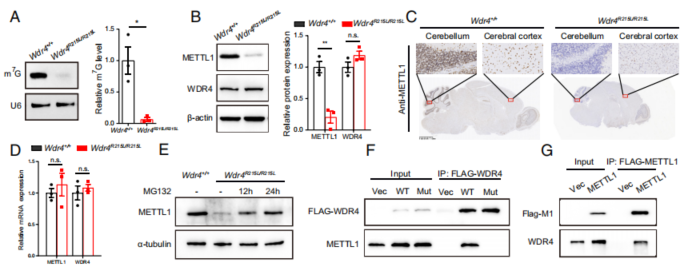
Fig. 4. Wdr4点突变通过蛋白降解降低METTL1稳定性
5. Wdr4点突变导致m7G tRNA修饰、mRNA翻译下调及内质网应激上调
作者利用TRAC-seq进一步探究Wdr4点突变对神经退化的影响,筛选到了含有m7G修饰的tRNA基序“RRRGGT”,并发现了突变小鼠脑部tRNA m7G修饰水平的显著下调,含m7G的tRNA水平下调但不含m7G的tRNA水平没有显著性变化(Fig. 5A-F)。嘌呤霉素实验结果显示,突变小鼠的嘌呤霉素摄入显著降低,即翻译水平显著下调(Fig. 5G)。作者接着对野生型和突变小鼠的脑部进行了多聚核糖体测序(Polysome-seq),以探究小鼠脑部mRNA的翻译效率,结果显示,在突变小鼠脑部翻译效率下调的基因带有更多的m7G tRNA携带的密码子,且TE的变化率与m7G 密码子出现的频率、数目以及编码序列的长度显著相关(Fig. 5H, I; Fig. S4A-C)。
TRAC-seq结果中,翻译效率下调的基因主要富集在细胞应激、脑部发育和mTOR信号通路上,而RNA-seq的结果中又富集到了上调的细胞应激通路,即细胞应激相关基因在转录水平上的上调和翻译水平上的下调(Fig. 5J-O)。此外Wdr4突变导致了内质网应激相关基因转录水平上的上调及该通路中关键分子IRE1和PERK的磷酸化水平上调,而降低PERK磷酸化水平则会同时使得促凋亡蛋白Bax和Bim的水平显著下调(Fig. 5P, Q;Fig. S5)。另外,由于文献报道过内质网应激与小胶质细胞激活之间的关联,所以作者也对此进行了验证,发现Ibal阳性的小胶质细胞在Day 35之后的突变小鼠小脑中快速扩张,与突变小鼠自Day 35开始出现小脑萎缩的表型一致(Fig. 5R)。
综上,作者证明了小鼠脑部的Wdr4点突变会下调tRNA在相应位点的m7G修饰和mRNA翻译,上调细胞应激和凋亡。
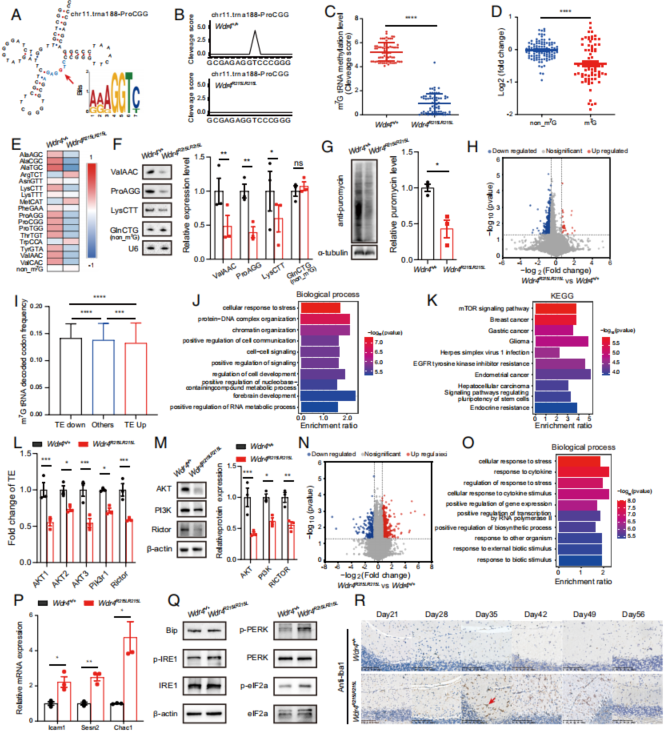
Fig. 5. Wdr4点突变引起tRNA m7G修饰下调,mRNA翻译水平下调和内质网应激上调
6. 回补实验及临床应用前景
关于回补实验的部分,作者循序渐进地设计了三种不同的回补实验:
首先是利用FDA已经批准的可缓解细胞应激的药物TUDCA对突变小鼠进行注射,注射治疗后的突变小鼠在脑部形态和功能方面均有显著的改善(Fig. S6)。
然而,尽管TUDCA的治疗是有效的,但作者显然不认为这是一种很理想的治疗方式,因为这样的治疗方式需要患者每天都注射TUDCA。所以作者设计了通过AAV-PHPeB转导野生型WDR4的来实现对突变小鼠进行治疗的方法,AAV-PHPeB对小鼠脑部的感染效率很高,同时也的确使得突变小鼠在接受治疗后,脑部的形态和相应功能得到了显著的恢复(Fig. 6)。
最后,作者利用iPSC诱导获得的人类神经元干细胞(NSCs)进行了体外实验,分别进行了TUDCA处理和野生型WDR4转导治疗,以评估这两种治疗方式对人类患者临床上常见位点突变WDR4的效果和潜在临床应用价值。这两种治疗方式都可以显著恢复WDR4突变的人类NSCs的增殖水平,并在分化的过程中缓解WDR4突变导致的凋亡(Fig. 7)。
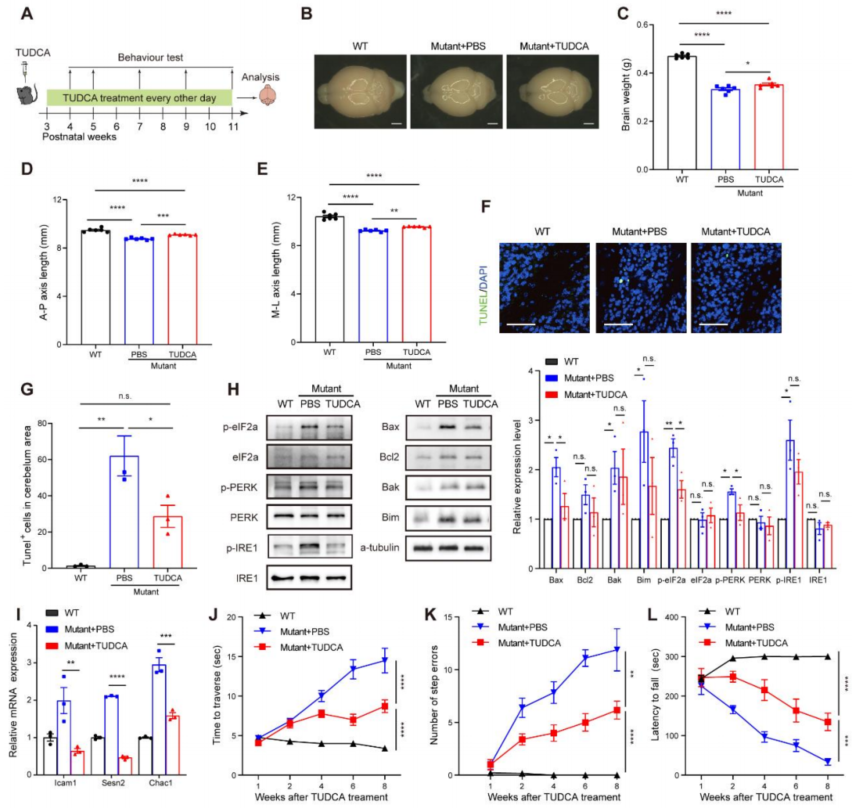
Fig. S6. TUDCA治疗tRNA m7G修饰下调小鼠的脑功能
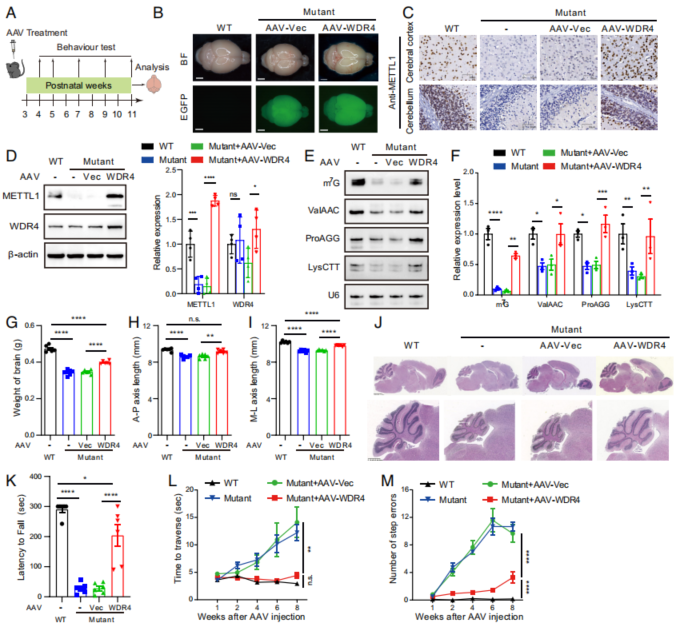
Fig. 6. tRNA修饰下调小鼠的长期治疗干预
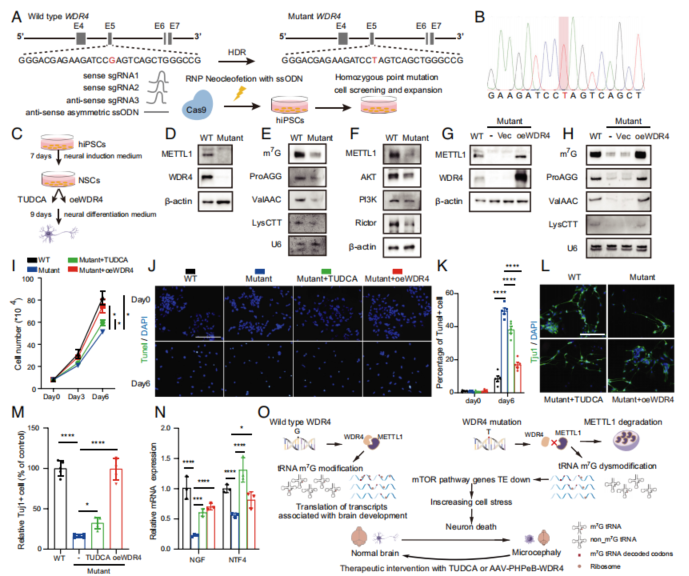
Fig. 7. TUDCA治疗或回补野生型WDR4提升带有WDR4突变的人类iPSC来源的NSC存活率和功能
研究总结
本文的完成度很高,作者的逻辑线非常清晰,从表型到机制再到回补都有详细深入严谨的探究,所有的实验设计和机制探索都紧紧围绕着临床上的表型展开,这也让文章的结论具有更大的可能被实际应用在临床治疗中,不难看出作者背景知识和实验设计方面的能力相当扎实。
本文中的snRNA-seq在本就完整连贯的故事铺陈基础上锦上添花,充分发挥了单细胞转录组学的最主要优势,即精确区分细胞之间在转录水平上的细微差异,并通过这种差异准确地找到了一种具有显著差异且与表型高度吻合的细胞亚型,作为本文故事主线的补充,也是向着另一个研究视角支线的初步探索。当然,本文的snRNA-seq数据中仍然有许多信息亟待挖掘和验证,或许未来可以进一步地精准地探明WDR4对作者发现的特定细胞类型/亚型的调控机制,或者WDR4对其他细胞类型/亚型存在的潜在调控等等,这些研究是一个逐渐发展的过程,所以这些就要期待作者或后人未来的研究了。
